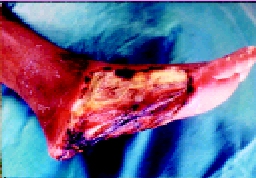
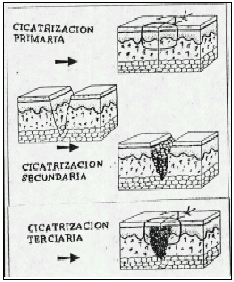
Cuando la herida deja de sanar por unión primaria ocurre un proceso más complicado y prolongado y que es la cicatrización por segunda intención causado por lo general por infección, trauma excesivo con perdida de tejido o aproximación imprecisa de los tejidos (espacio muerto cerrado).
En este caso la herida puede ser dejada abierta y permitir la cicatrización desde los planos más inferiores hacia la superficie.
El tejido de granulación contiene miofibroblastos que cierran la herida por contracción, el proceso de cicatrización es lenta y el cirujano puede requerir tratar el exceso de granulación que se destaca en los márgenes de la herida, retardando la epitelización, la mayor parte de las heridas y quemaduras infectadas cicatrizan en esta forma.
Cicatrización por Tercera Intención
También llamada como cierre primario retardado y esto ocurre cuando dos superficies de tejido de granulación están juntas. Esto es un método seguro para reparar las heridas contaminadas, asi también las sucias y las heridas traumáticas infectadas con grave pérdida de tejido y alto riesgo de infección, este método es usado ampliamente en el campo militar asi como trauma relacionado a accidente de automotores, de arma de fuego o heridas profundas penetrantes de cuchillo.
El cirujano generalmente trata las lesiones debridando los tejidos no viables y dejando la herida abierta, la cual gana gradualmente suficiente resistencia a la infección lo cual permite un cierre no complicado, este proceso esta caracterizado por el desarrollo de capilares y tejidos de granulación, cuando se emprende el cierre, los bordes de la piel y el tejido subyacente debe ser cuidadosamente y en forma eficaz aproximado, como si fuera por primera intención.
Es menos probable que se infecte la herida mientras está abierta, que la herida que ha sido cerrada en forma primaria. La herida cerrada tiene máxima susceptibilidad a la infección durante los primeros 4 días. La herida por injertos cutáneos es también un ejemplo de cicatrización por tercera intención.
Causas de Cicatrización Patológica
Factores Mecánicos.
Cruce de líneas de tensión.
Cicatrización defectuosa (Incremento de la tensión en la herida) falta de inmovilización del área de la lesión.
Factores Locales.
Localización región escapular, esternón linfostasis, inflamación prolongada (quemadura).
Factores raciales e individuales
Razas mediterráneas
Negros
Pelirrojos
Trastornos metabólicos
Diabetes
Latirismo
Deficiencia vitamínica: Vitamina C,K
Deficiencia proteínica
Deficiencia en oligoelementos: Zn, Cu, Co, Fe
Aterosclerosis
Enfermedades Neurológicas
Tabes dorsalis
Siringomieliaj
Para y tetraplejía
Acción física
Rayos ultravioleta, Rayos X , infecciones
Enfermedades infecciosas, sífilis, tuberculosis
Infecciones de heridas; abscesos, Flemones gangrena.
Enfermedades hematológicas y otros.
Cirrosis hepática, fibrosis Retroperitoneal
Fibrosis pulmonar insterticial
Epilepsia postraumatica, lepra
Enfermedad válvular reumática, contractura Dupuytren
Medicamentos
Cortisona, antiflogísticos, hormonas
Formas patológicas de formación de cicatrices
Cicatriz hipertrófica
Cicatriz atrófica
Queloide
Cicatriz inestable
Cicatriz pigmentada
Cicatriz retardada
Carcinoma de cicatrización
Clasificación de las Heridas
Presentamos las definiciones empleadas en el estudio de 1964 por el consejo nacional de Investigación, en el cual desempeñaron papel directivo la Universidad de Cincinnati y el Dr. Altemeier. Una herida se califico de infectada si producía pus.
Una herida que presentaba signos de inflamación o exudado seroso se calificó de "posiblemente infectada" . Estas heridas se vigilaron diariamente hasta que se resolvieron (no infectadas) o supuraron (infectadas).
Todas las heridas se incluyeron en una de las cuatro categorías siguientes, basándose en la estimación clínica de la contaminación de la herida observada por la enfermera en la sala de operaciones.
Herida Limpia.- No se observó infección, No hubo errores en la técnica aséptica. No se abrió ningún órgano muscular hueco. Sin embargo, se incluyeron tres operaciones -colecistectomía, apendicectomia e histerectomía- en esta categoría si no hubo inflamación alguna.
Herida Limpia Contaminada.- Se abrió un órgano muscular hueco, pero tuvo lugar un escape mínimo de contenido.
Herida Contaminada.- Se abrió un órgano muscular hueco, escape profuso de su contenido; o se descubrió inflamación aguda sin formación de pus.
Se incluía en este grupo una herida traumática de fecha menor de cuatro horas, igual que operaciones llevadas a cabo con un error importante en la técnica de asepsia.
Herida Sucia.- Al operar se encuentra pus, o una víscera perforada. En esta categoría se incluye cualquier herida traumática producida por más de cuatro horas3.
La meta del cirujano es mantener el cierre primario de la herida ante un paciente que va a ser sometido a una cirugía ya sea electiva o de emergencia y que los bordes de la herida que fueron escindido permanezcan en aposición o próximos por medios mecánicos hasta que se produzca la cicatrización y no necesite de estos soportes para recuperar la fuerza tensil, muchos factores tienen un impacto en el papel del cirujano ante un procedimiento y a la elección de materiales de cierre.
Esto analizaremos a continuación.
Factores que afectan la decisión quirúrgica de la sutura de heridas.
Factores Locales y Generales
Cicatrización secundaria y hormonas de las heridas. Buen número de biólogos con gran imaginación han sugerido en el transcurso de los años que los tejidos lesionados producen hormonas específicas de herida, sustancias que según se afirma circulan libremente en la sangre e incrementan la velocidad de la cicatrización .
Hasta la fecha ningún dato experimental decisivo apoya esta hipótesis. En la mayor parte de casos, las diferencias observadas en los ritmos de cicatrización dependen de otros factores.
Sin embargo, estos experimentos propiciaron una observación importante sobre el comportamiento de las heridas abiertas suturadas de nuevo.
A principios de la década de 1940, Botsford observó que las heridas incisas que se dejaron cicatrizar sin impedimento alguno durante breves periodos y que después se abrieron para suturarlas de nuevo inmediatamente adquirieron resistencia a una velocidad muy superior a la de las heridas primarias. Los experimentos de Dunphy14 y colaboradores, y de otros establecieron que este fenómeno de cicatrización secundaria de la herida estaba enteramente relacionado con los factores locales.
El contenido de colágena de las heridas secundarias extirpadas es al parecer el mismo o incluso menor que el de las heridas primarias de la misma edad.
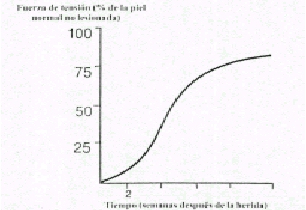
Sin embargo, las características relacionadas con el tiempo del metabolismo de la colágena cicatrizal parecen explicar la cicatrización secundaria. Como ya se dijo, las heridas primarias requieren varios días a fin de prepararse para la síntesis de colágena, y continúa sintetizándola y depositándola a ritmo acelerado durante periodos prolongados. La abertura y la nueva sutura de las heridas al parecer no ejerce efecto sobre el ritmo de depósito de nueva colágena33.
De este modo, en las heridas abiertas y nuevamente suturadas, así como en las heridas primarias, la adquisición de nueva resistencia depende al parecer menos del contenido de colágeno que de la velocidad de depósito de nueva colágena.
Factores Relativos a la Nutrición General.
Las heridas incisas en animales alimentados con dietas exentas de proteínas durante periodos prolongados adquieren resistencia lentamente. Aunque el plasma restablece la cinética normal de la herida, la concentración de proteínas plasmáticas no se correlaciona con las anomalías locales de la herida. La administración de DL- metionina o cistina tan sólo impide el retraso de la cicatrización. Este efecto no parece relacionado con síntesis de colágena, y es aún oscuro el mecanismo de los efectos de la depleción de proteínas sobre la cicatrización de las heridas. Aunque es motivo de preocupación frecuente, se desconoce todavía la magnitud del efecto de la depleción de proteínas sobre la cicatrización de las heridas en el hombre 27-28. Se ha pensado que también la senectud influye adversamente en la cicatrización. Los datos no sugieren que los mecanismos de este fenómeno sean más eficaces en el joven; las complicaciones de la cicatrización en el anciano al parecer dependen más bien de problemas pulmonares y cardiovasculares que de factores inherentes de la herida19.
Deficiencias de Vitaminas y Oligoelementos
Estudios experimentales indican que la síntesis de colágena puede progresar a ritmo bajo en animales con deficiencia de ácido ascórbico. Sin embargo, cuando las circunstancias requieren síntesis rápida, la depleción de este ácido ejerce efectos profundos sobre la producción de colágena. La administración de cantidades relativamente pequeñas de vitaminas C restablece la cicatrización normal, y no es necesaria la saturación . Aunque nos hemos referido a la función del ácido ascórbico en la síntesis de colágena, las anomalías fisiológicas en el escorbuto no se limitan al metabolismo de la colágena. El ácido ascórbico, potente agente reductor, está implicado al parecer en otros diversos sistemas de oxidorreducción. La cicatrización normal de las heridas requiere cantidades adecuadas de ácido ascórbico, pero los estados de deficiencia son raros en el mundo occidental salvo en alcohólicos o en individuos gravemente desnutridos. La vitamina A y su deficiencia han sido implicados en los fenómenos anormales de la cicatrización de las heridas. Aunque todavía no se ha profundizado plenamente en las consecuencias de la definición de vitamina A, se sospecha que dicha vitamina es un antagonista específico de ciertas anormalidades creadas por la cortisona y sus derivados13-16.
En la actualidad se estudia intensamente la participación de los metales en la cicatrización de las heridas. Como se conoce, son necesarios cobre y oxido ferroso para el metabolismo normal de la colágena, si bien rara vez se observan- quizá nunca - estados de deficiencia. El cinc y otros cationes divalentes actúan como cofactores en muchas reacciones metabólicas, y los estados de deficiencia en animales retardan la epitelización y el aumento de la resistencia. Se ha sugerido la deficiencia relativa de cinc como causa de epitelización deficiente en niños con grandes quemaduras. Sin embargo, los datos al respecto son todavía equívocos 8.
Anemia, Perdida de Sangre y Tensión de Oxígeno
Muchos clínicos creen firmemente que la anemia de cierto grado retrasa la cicatrización, así mismo ha quedado establecida la importancia de la tensión de oxígeno en la cicatrización.
Sabemos hoy que la caída prolongada de dicho parámetro dificulta notablemente la cicatrización. 43 Los datos sugieren que las concentraciones relativas de las isoenzimas de deshidrogenasa láctica ( LDH ) varían con la PO2 del tejido de la herida, y que pueden ser importantes en la regulación de la síntesis de colágena.
Para la cicatrización normal es al parecer más importante el riego tisular adecuado que la capacidad de aporte de oxígeno de la sangre. La hemorragia o la anemia solas quizá no alteren la tensión de oxígeno en los tejidos; sin embargo la hipovolemia, la vasoconstricción y el aumento de la viscosidad de la sangre pueden producir efectos profundos sobre la tensión local del oxígeno. La temperatura ambiente influye también en dicha tensión en la piel y afecta la cicatrización de las heridas, Por otra parte, las heridas adquieren nuevas resistencias más rápidamente a temperaturas ambientales elevadas. El riego sanguíneo local es al parecer decisivo, ya que el decremento de la vasoconstricción local por desnervación de la piel anula el efecto de la temperatura sobre la cicatrización.
La cuanción ocurre más rápidamente en la cara y en el cuello porque recibe el más grande suministro de sangre pero es más lenta a nivel de las extremidades. Así la presencia de cualquier conducción que comprometa el suministro de sangre a la herida, así como una pobre circulación a los miembros, como en el paciente diabético, llevaría a retrasar la cicatrización.
Fumar reduce la tensión de oxígeno de la sangre y del tejido subcutáneo de las heridas. El nivel de hipoxia producido por fumar se asocia con una curación defectuosa. La hipoxia dura unos meses después de la interrupción del hábito de fumar. Se cree que esto es debido a la vasoconstricción inducida por la nicotina. Los fumadores tienen más riesgos de necrosis de los colgajos cutáneos y de presentar úlceras periféricas .43
Estrés, Esteroides y Agentes Antinflamatorios
La cortisona y sus derivados reducen la velocidad de síntesis de proteínas, estabilizan las membranas lisosómicas e inhiben la reacción inflamatoria normal. En casi todas las especies estudiadas, incluyendo el hombre, las dosis altas de corticoides limitan la gemación capilar, inhiben la proliferación de fibroblastos y reducen el ritmo de epitelización. La administración experimental de esteroides antes de provocar una herida o inmediatamente después produce el efecto máximo. 16
En general, incluso con dosis altas de esteroides las reacciones de cicatrización de las heridas llegan a término; tan sólo se modifica la escala del tiempo. Todas las fases de la cicatrización progresan mucho más lentamente, y la mayoría de los clínicos coinciden en que en los pacientes que reciben terapéutica prolongada a base de esteroides y que deben someterse a intervenciones quirúrgicas es mucho mayor el riesgo de cicatrización demorada. Sin embargo, si se realizan ajustes cuidadosos en cuanto a la alteración de la escala del tiempo, puede minimizarse las complicaciones de la herida.
Los otros antinflamatorios usados con frecuencia (derivados salicílicos, fenilbutazona) ejercen efectos mínimos sobre la cicatrización. Es sabido que las dosis masivas experimentales de aspirina retrasan notablemente la ganancia de resistencia, pero las dosis farmacológicas no producen efecto alguno. 25
Algunos pacientes presentan alergias al material de sutura utilizado, al metal o prótesis. Lo que eleva su respuesta inmune en forma de rechazo a los tejidos.
Respuesta Inmune de los Pacientes Citotóxicos y Radiación
Los cambios crónicos inducidos en los tejidos por la energía radiante de onda corta producen efectos profundos sobre la cicatrización , los efectos de la radiación aguda y los de otros agentes citotóxicos influyen también en el ritmo de cicatrización. La mayor parte de los agentes citotóxicos producen sus mayores efectos sobre las células en división. Es lógico deducir de nuestra exposición previa que cualquier agente que inhiba la división de las células epiteliales o de los fibroblastos locales debe impedir o retrasar la cicatrización. Por fortuna, la administración sintética de mostaza nitrogenada. TioTEPA, 5- fluorouracilo y otros antimetabolitos rara vez producen concentraciones titulares suficientemente altas para influir en la división de las células en las heridas. Sin embargo, la aplicación local prolongada de estos agentes (sobre todo 5-fluorouracilo) puede impedir por completo la cicatrización. En forma análoga, las dosis altas de radiación, especialmente durante los tres primeros días , retrasan notablemente la ganancia de resistencia .
La Edad Del Paciente: Con el envejecimiento la piel y el tejido muscular pierde su tono y elasticidad, el metabolismo también se retarda y se daña la circulación, todos estos factores alargan la cicatrización .
El Peso Del Paciente: En los pacientes obesos de cualquier edad, debido al exceso de grasa a nivel de la herida se dificulta un buen cierre por planos y en adición, la grasa no tiene buen suministro de sangre, lo que hace más vulnerable a estos tejidos ante un trauma o una infección .
Deshidratacion.- Si existe una depleción de los fluidos en el cuerpo humano, los resultados del desbalance en la función del riñon, el metabolismo celular , la oxigenación de la sangre y la función hormonal no solo impactan en las condiciones generales del paciente y su recuperación quirúrgica, sino también que retrasan el proceso de cicatrización .
Respuesta Biológica Tisular
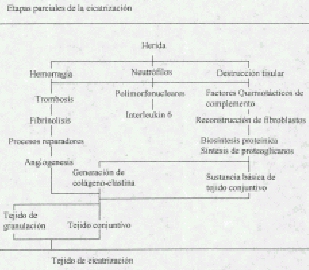
La cicatrización de las heridas representan una serie integrada altamente dinámica de acontecimientos celulares, fisiológicos y bioquímicos que ocurren exclusivamente en organismos completos. Aunque los componentes individuales de la reacción cicatrizal (multiplicación y emigración celular, síntesis y entrecruzamiento de colágena, etc.) se presentan en cultivos de tejidos o incluso en sistemas exentos de células, las heridas no cicatrizan en un frasco , ni se producen acontecimientos de ningún género en casos de aislamiento .
Si bien todas las heridas cicatrizan por los mismos procesos básicos, las heridas clínicas son de dos tipos: cerradas simples y abiertas, con pérdidas de tejidos o sin ella.
Heridas Cerradas. Respuesta Tisular a la Injuria.
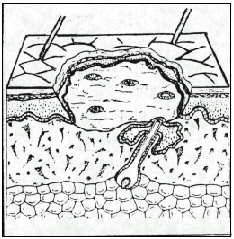
Inflamación. La destrucción de la integridad de los tejidos inicia una serie de cambios morfológicos en verdad sorprendentes. Después de una vasoconstricción transitoria se dilatan todos los pequeños vasos locales, y a medida que ocurre esta dilatación, el endotelio se torna anormalmente permeable para las proteínas y el plasma, los cuales llegan así al sitio de la lesión. Coincidiendo con los cambios vasomotores, los leucocitos comienzan a adherirse a las superficies endoteliales, especialmente de las pequeñas vénulas, y se desplazan activamente a través de las paredes vasculares. Pocas horas después de la lesión, el espacio de la herida se llena de un exudado inflamatorio muy rico en células compuesto de leucocitos eritrocitos, proteínas plasmásticas solubles y bandas de fibrina. La duración e intensidad de esta respuesta inflamatoria depende de la cantidad de tejido local lesionado. Desde luego que la lesión extensa de los tejidos o la presencia de cuerpos extraños o bacterias puede prolongar la fase inflamatoria durante meses. Sin embargo, en el caso usual de incisión limpia, la inflamación aguda mejora bastante en término de pocos días.
En las primeras etapas de la inflamación, leucocitos muy móviles emigran a la herida y comienzan a engullir y eliminar restos celulares y fragmentos de tejido lesionado. En primer lugar predominan al parecer los leucocitos polimorfonucleares. Al finalizar la fase transitoria de emigración leucocítica (diapédesis) y morir y sufrir lisis los granulocitos de vida breve y liberar éstos hidrolasas ácidas en el medio local, aumenta significativamente la proporción de monocitos, y los índices de supervivencia diferencial explican las modificaciones de la población celular. Los monocitos persisten en su actividad fagocítica durante semanas.
Estudios con antisueros anticelulares específicos sugieren que la cicatrización progresa normalmente en ausencia de linfocitos y de granulocitos polimorfonucleares. En contraste, debe haber monocitos para la producción de fibroblastos normales e invasión del espacio de la herida. 26
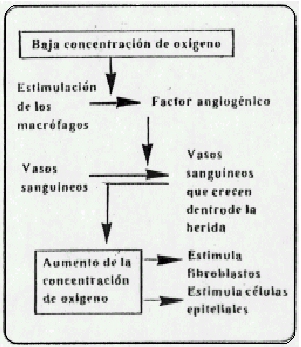
Epitelización. Mientras se eliminan los materiales muertos de las regiones más profundas, ocurren acontecimientos muy importantes en los bordes de las heridas epiteliales. En efecto, las heridas cutáneas, la epidermis inmediatamente vecina al borde de la herida comienza a engrosarse 24 horas después de la lesión. Las células básales marginales pierden su firme adherencia a la dermis subyacente, aumentan de volumen y entonces comienzan a emigrar cruzando el defecto. Las células básales fijas en una zona cercana al borde seccionado experimentan una serie de divisiones mitóticas rápidas y las células hija emigran, presumiblemente dirigidas mediante guía por contacto a lo largo de las bandas de fibrina y por inhibición de contacto 38. En término de 48 horas la superficie de la herida en su totalidad está cubierta de nuevo de epitelio.
En este momento, las anfractuosidades más profundas de la herida contienen tan sólo bandas de fibrina y células inflamatorias. Después de formarse puentes a nivel del defecto, las células epiteliales emigrantes pierden su aspecto aplanado, adoptan una forma más cilíndrica e incrementan su actividad mitótica. Se establece así la formación de capas de epitelio con queratinización de las células de la superficie. Sin embargo, la interfase epitelial mesenquimatosa no recupera nunca su arquitectura norma.
La notable respuesta de las células epiteliales a la lesión no queda restringida a las áreas superficiales .Por ejemplo, si persisten durante varios días suturas en heridas cutáneas, las células epiteliales emigran hacia ellas, y la queratinización y el engrosamiento epitelial subsiguiente pueden producir reacciones manifiestas de cuerpo extraño y formación de abscesos estériles. Incluso las suturas subcuticulares que seccionan folículos pilosos o glándulas sudoríparas pueden quedar rodeadas de bandas de epitelio y producir quistes epiteliales 39 .
Fase Celular. A medida que mejora la reacción inflamatoria y que aumenta el espesor de la superficie epitelial, aparece un nuevo tipo de células en la profundidad de la herida. A partir del segundo o tercer día, una serie de células fusiformes con núcleos ovales aumentan notablemente en número, y al cabo de 10 días dominan la población celular, poco después de esta invasión de células aparecen fibras de colágena en la herida. Datos concluyentes indican que este nuevo tipo de célula, el fibroblasto, sintetiza y secreta moléculas de colágena. Aunque en términos generales el fibroblasto activo se describe como una célula fusiformes o estrellada, observaciones directas de material vivo revelas que los fibroblastos pueden adoptar casi cualquier configuración .
Datos recientes indican que casi todos los fibroblastos vivos en las heridas en trance de cicatrización derivan de células mesenquimatosas locales, especialmente de las asociadas con la adventicia del vaso sanguíneo
Si las células circulantes son capaces de convertirse en fibroblastos fijos, como sugieren algunos autores, desempeñan sin duda un cometido insignificante en la cicatrización de las heridas.
En el momento en que los fibroblastos locales comienzan a moverse en la herida, el espacio de ésta se llena de bandas de fibrina. Aunque al parecer los fibroblastos migratorios utilizan la red de fibrina como andamiaje, no sabemos todavía si las bandas de fibrina proporcionan orientación o guía por contacto. Sin embargo, a diferencia de las células amiboides, las células epiteliales y los fibroblastos requieren un sustrato sólido o semisólido para sus movimientos de deslización. Los fibroblastos y células epiteliales se desplazan por formación de contacto adhesivos con el sustrato, no por flujo citoplásmico.
Los fibroblastos no poseen enzimas fibrinolíticas. Grandes cantidades de fibrina, coágulos sanguíneos o tejidos muertos forman una barrera física que impide la penetración del fibroblasto y retrasa la producción de fibras de colágena. Por fortuna, el fibroblasto cuenta con una ayuda.
En efecto, la proliferación rápida de los capilares constituye un rasgo prominente de toda cicatrización temprana de una herida. En las heridas abiertas o cerradas se forman nuevos capilares por gemación de las vénulas existentes.
Las células endoteliales proximales a la lesión experimentan mitosis rápida y las distales pierden sus fijaciones a la membrana basal y se movilizan en el interior del área lesionada. A diferencia de los fibroblastos, el endotelio se desplaza como una lámina contigua .Como las células endoteliales proliferan a partir de muchos puntos, pronto se establece una rica red de pequeños vasos. Las células endoteliales poseen un activador muy poderoso de plasminógeno. Así a medida que los fibroblastos avanzan en el área lesionada, seguidos de cerca por los capilares en proliferación, ocurre fibrinólisis que destruye la red de fibrina.
Fibroplasia . La fase celular fija de la cicatrización de la herida dura varias semanas. Sin embargo, hacia la cuarta o quinta semana disminuye notablemente el número absoluto de fibriblastos en la herida . Además, la rica red capilar queda reducida a unos pocos sistemas de capilares bien definidos . Durante toda la vida de la cicatriz, un pequeño número de células permanece asociado con el material cicatrizal, pero estos fibrocitos no poseen el retículo endoplásmatico activo característico de los fibroblastos.
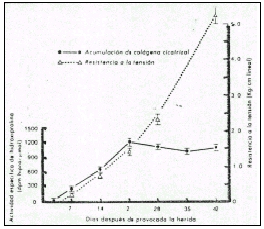
A medida que disminuye la población de fibroblastos, las fibras de colágena se convierten en el rasgo anatómico dominante de las herida. Las primeras fibras de colágena aparecen cuatro o cinco días después de la lesión, y rápidamente el espacio de la herida se llena de pequeños haces de fibras orientados al azar los cuales aumentan gradualmente de volumen y producen una estructura densa y masiva de colágena (la cicatriz) que une firmemente los bordes de los tejidos seccionados. Todas las cicatrices, profundas y superficiales, cambian de volumen y forman de manera lenta y progresiva con el curso de los años. En algunas personas poco afortunadas las cicatrices se agrandan y producen queloides masivos o cicatrices hipertróficas. En otras, la zona palidece, disminuye su volumen, reaparece la pigmentación normal y termina por desaparecer la cicatriz. El tejido cicratizal en casi todas las incisiones abdominales permanece firme y resistente, aunque a veces las cicatrices de abdomen se desplazan, se amplían y pierden resistencia, y de este modo ocurre hernias incisionales.
El fenómeno del remodelado de la cicatriz es básico para el funcionamiento de los tejidos lesionados El aspecto macroscópico de las cicatrices en trance de remodelado sugiere que con el tiempo y por un mecanismo desconocido las fibras de colágena se han modificado y entrelazado formando diferentes patrones arquitectónicos.
Inflamación. Desde los comienzos de este siglo, en varios estudios experimentales se demostró concluyentemente que las sustancias locales liberadas por la lesión producen vasodilatación y una mayor permeabilidad de vasos finos. En un principio se consideró a la histamina el mediador primario de la respuesta inflamatoria vascular. Como es sabido la histamina, liberada por granulocitos, células cebadas y plaquetas, produce vasodilatación local y permeabilidad de los pequeños vasos. Aunque existe en los exudados inflamatorios tempranos, la histamina actúa durante breves períodos (menos de 30 minutos) debido a que sus fuentes locales se agotan rápidamente. En el hombre los efectos locales de la serotonina son insignificantes. Debido a lo breve de su acción, no parece probable que dependan de estas aminas las reacciones inflamatorias prolongadas.
Recientemente se ha implicado a las cininas, una serie de péptidos biológicamente activos, y a las prostaglandinas, principalmente PGE 1, y PGE 2, en las respuestas vasculares inflamatorias locales. La calicreína, enzima encontrada en el plasma y en los granulocitos, libera bradicinina y kalidina a partir de la O alfa globulina del plasma. En presencia de cininas y el sistema de complementos, las células locales producen diversas prostaglandinas, que actúan probablemente regulando los niveles del nucleótico cíclico de la célula. Las prostaglandinas al parecer son los mediadores finales de la inflamación aguda, incluyendo la permeabilidad reversible de vasos finos, y posiblemente tengan una función quimiotáctica en fibroblastos y leucocitos. Aspirina e indometacina son potentes inhibidores de la biosíntesis de prostaglandina, y la acción antiinflamatoria de estos fármacos puede deberse a sus efectos sobre el matabolismo de la protaglandina.
La segunda fase de la respuesta inflamatoria, esto es la invasión local por los leucocitos puede tener también mediadores químicos. Se llegó a creer que la leucotaxina, para algunos un péptido formado en los tejidos lesionados por la destrucción enzimática de la albúmina, era un agente quimiotáctico, que atraía los leucocitos hacia las áreas lesionadas. No han tenido actividad quimiotáctica en las concentraciones encontradas en los tejidos lesionados . Los extractos de leucocitos e incluso ciertas formas de colágena producen quimiotaxis leucocitaria en situasiones experimentales, si bien no se ha dilucidado su papel en la cicatrización de las heridas.
Sustancia Fundamental
Las cicatrices maduras y en desarrollo poseen los mismos componentes extracelulares básicos de todo tejido mesenquimatoso, es decir, proteínas fibrosas principalmente (colágena) y glucosaminoglicanos (mucopolisacáridos, mucoproteínas y glucoproteína). Todos los tejidos conectivos contienen cantidades variables de glucosaminoglicanos, que son macromoléculas gigantescas compuestas principalmente de carbohibratos y de una cantidad variable de proteínas, los primeros estudios histoquímicos y determinaciones de hexosamina sugirieron que durante los tres o cuatro primeros días de la cicatrización, las heridas sintetizan grandes cantidades de glucosaminoglicanos. Durante los días siguientes, a medida que aparece la colágena en la herida, el contenido de hexosamina disminuye drásticamente. Los investigadores concluyen que la producción y depósito de mucopolisacáridos prepara y dirige a los fibroblastos para producir colágena. Por desgracia los valores de hexosamina por sí solos no reflejan con exactitud el contenido de glucosaminoglicanos de la herida. El análisis detallado de los tipos de compuestos ricos en hexosamina brinda pruebas concluyentes de que el aumento temprano refleja la aparición de glucoproteínas séricas transportadas a la herida por el exudado inflamatorio inicial, por lo que no se trata de compuestos sintetizados localmente 14.
 |
Fig. #6 Relación entre los niveles de los constituyentes de las heridas con el tiempo y las fases de la curación. |
|
|
Por lo general el contenido de ácido hialurónico del tejido de la herida permanece relativamente constante o dismiuye durante las tres primeras semanas de la cicatrización. Por el contrario, la concentración de condroitina-4- sulfato y de dermatán sulfato aumenta progresivamente desde el cuarto hasta el vigésimo primer día. La aparición de las fibras de colágena no produce caída brusca en la concentración . Hasta la fecha, no se ha establecido un papel claramente definido de los glucosa-minoglicanos en la cicatización de las heridas.


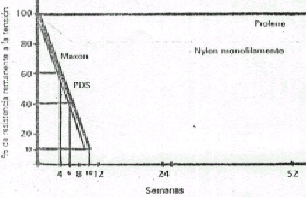

Muy bueno, el contenido es esencial, se nota el trabajo y dedicación puestos en el mismo.
ResponderEliminar